نمونه گیری در حیوانات آزمایشگاهی ( خون گیری ) چگونه است؟
مقدمه
اهمیت علم خون شناسی به قدری است که اکثر آزمایش های بالینی بر روی خون انجام می شود و به تبع آن، نمونه برداری صحیح و ارسال مناسب آن به آزمایشگاه اولین و مهم ترین گام در دقیق بودن نتیجه آزمایش ها میباشد، بنابراین باید با اصول صحیح نمونه گیری در حیوانات آزمایشگاهی مختلف آشنا بوده و در نهایت دقت و تجربه این کار را به انجام رسانیم. در پایان بسیاری از فعالیت های پژوهشی و آزمایشاتی که بر روی حیوانات آزمایشگاهی انجام می شود به نمونه گیری از بافته ای مختلفی نیاز داریم تا نتایج آزمایشات را بررسی کنیم. در این بخش به صورت مختصر، به یکی از روشهای نمونه گیری در حیوانات آزمایشگاهی تحت عنوان خون گیری اشاره می شود.
1- جمع آوری خون
اولین مرحله در آزمایش خون، که متضمن صحت یک آزمایش است، انجام نمونه برداری صحیح از خون میباشد. نمونه ممکن است از سیاهرگ،سرخرگ یا مویرگ اخذ شود. خونگیری از سیاهرگ برای ارزیابی بالینی-آسیب شناسی کاربرد دارد، در حالی که خونگیری از سرخرگ برای ارزیابی گازها و pH خون انجام می شود؛ زیرا خون سرخرگی تحت تاثیر فرآورده های حاصل از متابولیسم قرار نمیگیرد. علت دیگر برای جمع آوری خون از سرخرگ ها این است که میتوان مقدار زیادی نمونه را با سرعت و سهولت بیشتر اخذ نمود. خونگیری از مویرگ ها اگرچه آسان تر از خونگیری از سیاهرگ و سرخرگ است، اما نمونه اخذ شده کم بوده و برای انجام بسیاری از آزمایش ها نامناسب است؛ از جمله این آزمایش ها، بررسی پلاکت هاست، زیرا در هنگام خونگیری از مویرگ ها پلاکت ها در محل اخذ خون تجمع مییابند، ضمنا باید توجه کرد که در هنگام اخذ خون از مویرگ ها، در محل خونگیری فشار بیش از حد آورده نشود؛ زیرا باعث می شود آب داخل سلولی و مایع ناشی از له شدگی بافت وارد خون شده و خون را رقیق کنند که موجب اختلال در نتیجه آزمایش خواهد شد.
دستورالعمل جمع آوری نمونه خون، بسته به نوع، سن، جنس، گونه، جثه، سلامت حیوانات وحجم خون مورد نیاز متفاوت است. کمترین حجم خون مورد نیاز به منظور انجام یک آزمایش در ابتدا تعیین گردیده و حجم خون اخذ شده دست کم باید دو برابر کمترین مقدار مورد نیاز باشد.
انتخاب روش خونگیری به چند فاکتور بستگی دارد:
1) شخص نمونه گیرنده باید کاملا کارآزموده باشد.
2) اطلاع از وضعیت سلامت حیوان در هنگام خونگیری و آگاهی از میزان آب بدن حیوان
3) مدت زمان و تعداد دفعات خونگیری
4) نوع آزمایش و نوع حیوان مورد آزمایش
5) براساس نوع آزمایش مورد نظر، موضع نمونه گیری متفاوت خواهد بود.
6) ادامه آزمایش یا پایان آزمایش یا بعبارتی زنده مانی یا زنده نمانی حیوان، میتواند در تعیین روش ونگیری موثر باشد.
7) اطمینان از سترون بودن لوازم خونگیری و خشک بودن آنها مهم میباشد.
8) انتخاب ماده ضد انعقاد مناسب براساس نوع آزمایش
9) تحمیل کمترین استرس به حیوان تا بتوان داده های فارماکوکینتیکی وفارماکودینامیکی بهتری را فراهم آورد.
10) حجم خون مورد نیاز
11) نوع خون مورد نیاز (سرخرگی، سیاهرگی یا ترکیبی)
12) نیاز به سرم یا پلاسما پس از خونگیری
2- لوازم خونگیری
نوع لوازمی که در خونگیری به کار میرود، بستگی به محلی دارد که قرار است نمونه خونی از آنجا گرفته شود. در مورد نمونه های خون سرخرگی، یک سرسوزن و سرنگ مورد نیاز است و نمونه ها نیاز به مراقبت ویژه دارند، بعد از خونگیری باید هوای داخل سرنگ را کاملا تخلیه کرد و نوک سوزن را بلافاصله بعد از خونگیری مسدود نمود. خون سیاهرگی را میتوان با استفاده از یک سرنگ شیشهای یا پلاستیکی و یا سیستم خلاء (ونوجکت) جمع آوری نمود. در صورت انتخاب سرنگ برای خونگیری، بهتر است از سرنگ پلاستیکی استفاده شود، چرا که پلاکت ها در دیواره داخلی سرنگ شیش های تجمع پیدا کرده و نتیجه آزمایش سنجش پلاکت را با اختلال مواجه میکنند. اندازه سر سوزن بر مبنای جثه حیوان و اندازه یاخته های هر گونه انتخاب می شود. بطور کلی باید تا حد امکان از بزرگترین اندازه ممکن استفاده نمود. در مورد اکثر دامهای کوچک و حیوانات آزمایشگاهی سرسوزن های با اندازه 20 تا 30 مناسب اند. استفاده از سرسوزن های کوچکتر میتواند منجر به آسیب دیدن سلول های خونی و همولیز نمونه شود. قبل از انتقال خون از سرنگ به لوله آزمایش باید سرسوزن را برداشت. در صورتی که خون با فشار از داخل سرسوزن تخلیه شود، ممکن است گلبول های قرمز پاره شده و منجر به انهدام یا همولیز گلبول های قرمز شوند.
خونگیری از مویرگ ها یا نمونه گیری از خون محیطی معمولا بطور مستقیم به داخل لوله موئینه جمع آوری میشود. از یک سرسوزن استریل و یا لانست برای سوراخ کردن پوست و رگ خونی زیر پوست استفاده می شود. برای این منظور تیغه اسکالپل توصیه نمیشود، چون در صورت بی دقتی و استفاده نابجا از آن باعث آسیب دیدگی حیوان و شخص خون گیرنده می شود. چند قطره اول نیز آلوده به مایعات بافتی و سلول های آسیب دیده خونی میشود. لذا قبل از آغاز نمونه برداری باید این چند قطره را پاک کرد و سپس نمونه گیری را انجام داد.
3- محل خونگیری
محل خونگیری معمولا به جثه حیوان و حجم خون مورد نیاز ودر صورت بیمار بودن حیوان، به نوع بیماری نیز بستگی دارد.
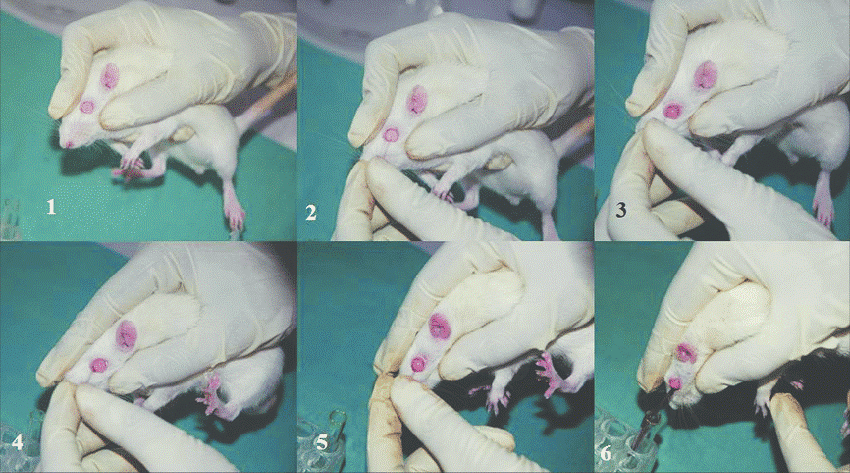
4- مقیدسازی
مقیدسازی حیوان باید در خلال خونگیری انجام گیرد. بهتر است برای مقید کردن تا حد امکان، کمترین دستکاری را اعمال نمود. دو نوع مقید سازی وجود دارد: 1- مقیدسازی شیمیایی (داروهای آرامبش و بیهوشی)، 2- مقیدسازی فیزیکی (مکانیکی). استفاده از مقیدکننده های فیزیکی و نیز ابزار آلات خاص این روش میتواند باعث تحریک یا تهییج و برآشفته شدن حیوان شود و این گونه تنش ها می تواند منجر به انقباض طحال شده و پدیده مذکور باعث تغییر پارامترهای خونی خواهد شد.
5- آماده سازی محل خونگیری
الف) تراشیدن محل خونگیری: پس از مشخص شدن محل خونگیری، در برخی موارد باید مو چینی و یا تراشیدن مو انجام گیرد. مو چینی با قیچی می تواند بدون ایجاد تنش در خرگوشها به آسانی انجام گیرد. از کرم های موبر شیمیایی نیز میتوان در سطوح نامسطح استفاده کرد. اما از آنجایی که این کرم ها گاهی موجب ملتهب شدن پوست و آلوده شدن نمونه می گردند،زیاد توصیه نمی شوند. پوست تعدادی از حیوانات بطور مثال خرگوش نیز به مواد شیمیایی موبر حساسیت نشان میدهند. استفاده از تیغ و صابون به علت احتمال آسیب رساندن به پوست توصیه نمی شود.
حیوانات در حین عمل مو چینی عکس العمل هایی مانند بیقراری و جیغ کشیدن را مبنی بر درد و اذیت شدن از خود نشان میدهند که باید با نوازش کردن و صحبت کردن آنها را آرام نمود.
ب) ضد عفونی کردن محل خونگیری: محل خونگیری باید کاملا تمیز باشد، این کار برای عمل خونگیری بسیار مناسب است. استریلیزه کردن پوست غیرممکن است، اما بهتر است محل را بوسیله اسپری مواد ضدعفونی کننده، ضد عفونی کنیم تا مواد و اجزای اضافی و میکروب های مضر از بین بروند. همچنین باید از زدن الکل بیش از حد خودداری نمود، زیرا احتمال همولیز نمونه را افزایش می دهد.
الکل 70% به همراه آب برای تمیز کردن و چربی زدایی پوست (چربی های حاصل از غده ترشح کننده چربی) در گونه های مختلف موثر است. محل خونگیری می تواند در اثر ضدعفونی، دهیدراته شده وموجب سوزش پوست وناراحتی حیوان شود.
6- حجم خون
در حیوانات سالمی که تغذیه سالم و مناسبی دارند بیشتر از 15 درصد از حجم خون در حال گردش را میتوان برای یکبار اخذ نمود ولی در حیوانات چاق و مسنتر باید کمتر از 15 درصد اخذ شود.
بیشترین حجم خونی که میتوان اخذ نمود:
- به مقدار 10 درصد حجم خون، یکبار در هفته توصیه می شود.
- به مقدار 20 درصد حجم خون، یکبار در ماه توصیه می شود.
- بالای 20 درصد حجم خون، باید تحت بیهوشی عمومی و فقط به عنوان روش نهایی انجام گیرد؛ زیرا احتمال زنده ماندن حیوان پس از این مقدار خونگیری نزدیک به صفر است.
در اغلب حیوانات، کل حجم خون بدن حیوان زنده در حدود 8 درصد وزن بدن آن حیوان است. اگر حجم نمونه خون اخذ شده بیش از 10 درصد کل حجم خون بدن حیوان باشد، کاهش حجم خون و نارسایی قلبی-عروقی همراه با شوک ممکن است بوجود آید. بطور کلی حداکثر حدود 8 ml/kg bw حیوان زنده میتوان اخذ نمود.
شایان ذکر است حجم خون برداشتی با توجه به جدول زیر قابل محاسبه است و میتوان براساس حجم مورد نیاز و تعداد دفعات خونگیری محاسبات لازم را انجام داد.
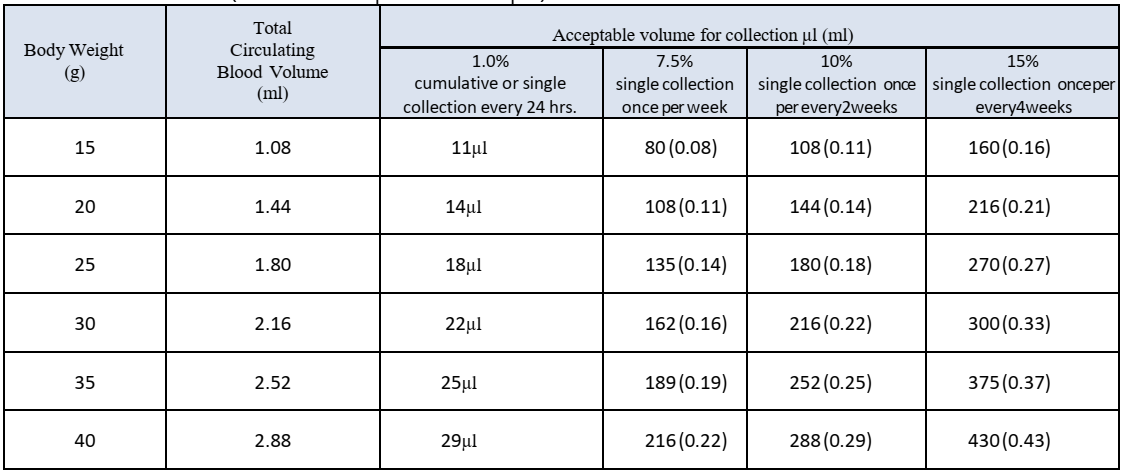
جدول-1: حجم خون قابل برداشت و حجم کل خون در گردش بر اساس وزن بدن موش سوری
جدول-2: حجم خون قابل برداشت و حجم کل خون در گردش بر اساس وزن بدن موش صحرایی (رت)
7- خطاهای معمول در خونگیری
در هنگام نمونه برداری از خون احتمال بروز خطاهایی وجود دارد که برای پیشگیری از این خطاها باید به موارد زیر توجه ویژهای داشت:
1) حتما از سرنگ خشک استفاده شود، زیرا مرطوب بودن سرنگ باعث انهدام یاختههای قرمز میشود.
2) هنگام تخلیه خون از سرنگ به داخل لوله آزمایش حتما باید سرسوزن از سرنگ جدا شود تا خون بدون فشار و به آرامی از سرنگ خارج شود، زیرا در غیر اینصورت غشاء گلبولهای قرمز در هنگام خروج پاره شده و باعث از بین رفتن گلبول های قرمز می شود.

3) اگر از مواد ضد انعقاد در مقادیر مناسب استفاده نشود، ممکن است میزان کم مواد ضد انعقاد باعث لخته شدن خون و زیاد بودن آن باعث تغییر در مورفولوژی سلول های خونی شود.
4) وقتی که از مواد ضد انعقاد استفاده میشود باید خون حاوی ماده ضد انعقاد را در لوله تکان داد تا از لخته شدن خون جلوگیری شود، در عین حال باید از تکان دادن شدید لوله نیز اجتناب کرد، زیرا این امر باعث پارگی غشاء گلبول های قرمز و همولیز خون و همچنین ایجاد کف شود که باعث بروز خطا در نتیجه آزمایش میشود.
5) انجام هر چه زودتر آزمایش بر روی نمونه خون بسیار مهم است، در صورتی که زمان آزمایش با تا تاخیر انجام شود باید در این مدت نمونه در محل سرد و یا در داخل یخچال نگهداری شود. تاخیر بیش از حد در انجام آزمایش ممکن است باعث تغییرات زیادی در فاکتورها و سلول های خونی شود (حداکثر 24-12 ساعت).
8- نحوه نگهداری از نمونه های خون
بهترین زمان برای ارزیابی نمونه خون حداکثر تا یک ساعت پس از اخذ آن میباشد و در غیر این صورت، نمونه های خون حداکثر به مدت 24 ساعت در یخچال نگهداری می شوند. نمونه های خون را میتوان به مدت چند ساعت در جعبه هایی که به خوبی بسته بندی شدهاند به طوری که هوا به داخل آنها راه نیابد، در مجاورت یخ نگهداری نمود.
9- مواد ضد انعقاد
هنگامی که یک نمونه خون جمع آوری شد، ظرف مدت 2 الی 5 دقیقه منعقد می شود. در برخی آزمایش های خونشناسی نباید خون مورد بررسی لخته شود، برای این کار از مواد ضد انعقاد استفاده میشود. نمونه خونی بایستی به آرامی با ماده ضد انعقاد مخلوط شود و از هم زدن سریع اجتناب نمود، زیرا این امر باعث ایجاد کف و شکستن سلول ها میگردد.
از آنجایی که امروزه بخش عظیمی از تحقیقات در حوزه علوم زیستی، شامل انجام آزمایش های بیشمار بر روی حیوانات زنده میباشد و نیازمند حضور این موجودات دوست داشتنی در آزمایشگاه ها هستیم و از طرفی این تحقیقات ابزار مهمی در پیشرفت علم شناخته می شوند، لذا ضرورت دارد قبل از شروع به کار با توجه به حجم و نوع نمونه مورد نیاز، روشی را انتخاب کنیم که میزان تنش و درد کمتری داشته و اگر لازم نباشد از روش های انتهایی استفاده نکنیم.
خونگیری در موش سوری و موش صحرایی
پس از مقیدسازی و آماده سازی حیوانات (انجام بیهوشی عمومی یا بی حسی موضعی) میتوان به روشهای مختلف و از محلهای متفاوتی از قبیل؛ سینوس پشت چشمی (Retro Orbital Sinus)، چیدن نوک دم، خونگیری مستقیم از قلب، قطع سر، سیاهرگ وداج (Jugular Vein)، رگهای نوک پا (Dorsal Pedal Vein)، سیاهرگ فک پایین صورت (Facial Vein)، سیاهرگ اجوف پشتی (Posterior vena cava)، سیاهرگ سافنوس (Saphenous Vein)، عروق زیر بغلی (Axillary Vein) خونگیری کرد. با توجه به اهمیت خونگیری به شرح هر یک از روش های خونگیری در موش سوری و موش صحرایی که در مجموعه آزمایشگاه نیکوفارمد نیز انجام می شوند، پرداخته می شود.
1- رگ های نوک پا (Dorsal Pedal Vein): در این روش بهتر است به منظور افزایش خونرسانی موضع مورد نظر، دمای محل خونگیری را افزایش داده و با انگشتان شست و اشاره اطراف مچ پای حیوان را گرفته و با استفاده از سر سوزن های شماره 23 الی 27، میتوان از عروق داخلی پشتی پا که در نوک پا قرار گرفته اند خونگیری نمود.
2- بریدن سر: این روش نیاز به بیهوشی عمیق داشته و میتوان برای جمع آوری مقدار زیادی خون از حیوانات کوچک تر از این روش استفاده نمود. با قطع سر جریان خون از قسمت گردن متصل به تنه به کمک یک قیف در داخل ظرف مورد نظر جمع آوری می شود. جریان خون در این روش با ترشحات نایی و بزاقی می تواند آلوده شود.
3- سیاهرگ اجوف پشتی (Posterior vena cava): این روش نیاز به بیهوشی کامل داشته و برای خونگیری از این سیاهرگ محوطه شکمی را به شکل V برش داده و روده ها را به سمت چپ و کبد را بسمت جلو می کشیم. باید توجه داشت که این روش یک روش انتهایی است. برای خونگیری از عریض ترین بخش رگ که در بین کلیه ها قرار دارد، استفاده می شود. به منظور خونگیری از سر سوزن های شماره 23 الی 25 استفاده می شود.
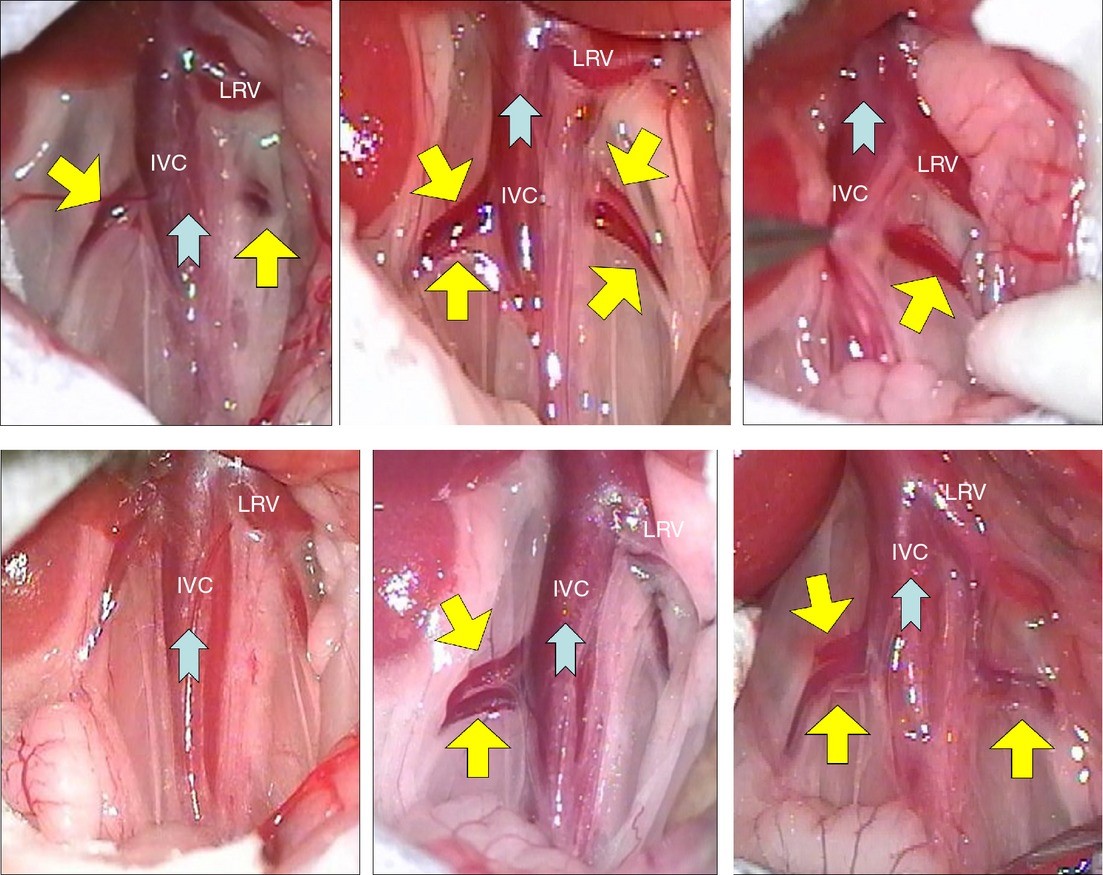 |
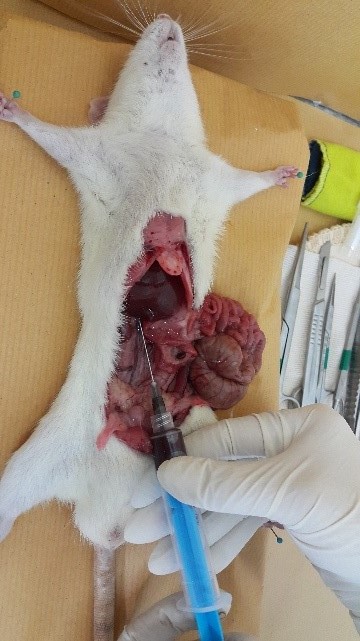 |
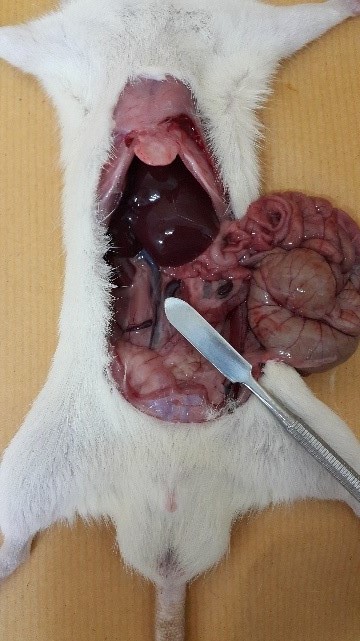 |
4- عروق زیر بغلی (Axillary Vein): این روش نیز نیازمند بیهوشی کامل بوده و در این روش باید حیوان را به پشت خوابانیده (دستها کاملا به جلو کشیده و به میز مقیدسازی بسته شود)، یک برش عمیق در ناحیه سینه ایجاد میکنیم و پوست را به ناحیه پشت برش کشیده و یک فضای باز برای خونگیری و برش عروق ایجاد می کنیم. در این روش احتمال آلودگی خون با مایعات بافتی وجود دارد و این روش خونگیری نیز یک روش انتهایی می باشد.
|
|
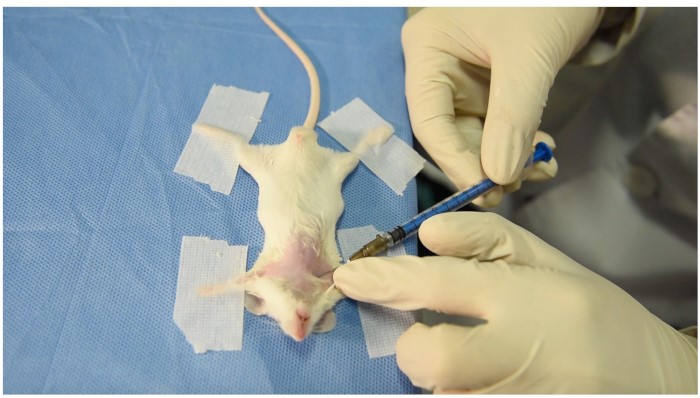 |
 |
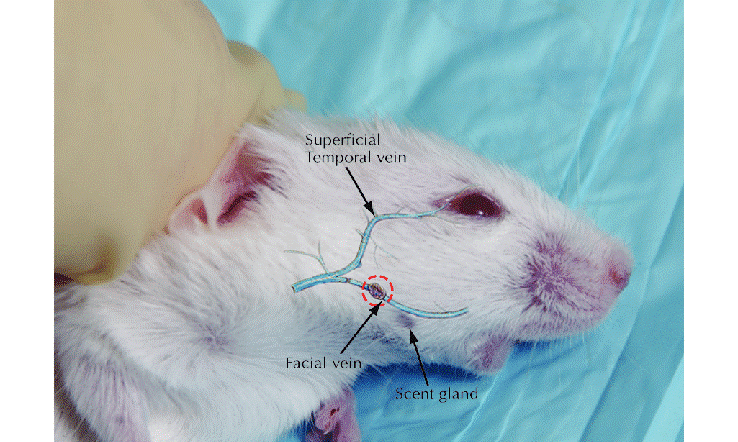
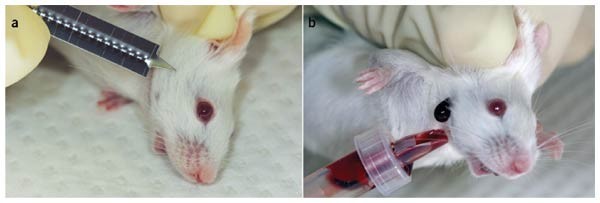
5- سیاهرگ فک پایین صورت (Facial Vein): این روش مختص موش و رتهای بالغ بوده و میزان خون اخذ شده متوسط و یا نسبتا زیاد بوده و با تغییر محل خونگیری میتوانیم نمونهگیری مداوم و پشت سر هم داشته باشیم. خون اخذ شده میتواندمخلوطی از خون سیاهرگی و سرخرگی باشد و نیاز به بیهوشی نیست؛ ولی بهتر است حیوان به خوبی مقید شود و همچنین نیاز به تجربه بالا و تجهیزات خاصی ندارد. سرعت عمل بالایی دارد و بهتر است از سرسوزنهای شماره 19 و یا کوچکتر استفاده شود. همچنین میتوان از لانست برای نیشتر زدن و جمعآوری خون جاری شده از محل نیشتر بهره گرفت.
 |
 |
 |
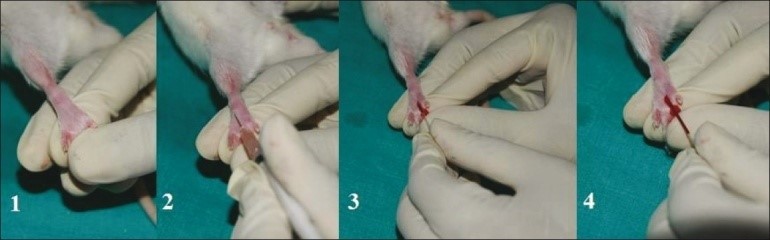
6- چیدن نوک دم (Tail Clip Bleeding): حجم کمی از خون (مثلا یک قطره) ممکن است با روش بریدن انتهای دم گرفته شود که شامل مخلوطی از خون وریدی، شریانی و مایع بافتی خواهد بود. این روش در مواقعی که نمونه های کوچک هر چند ساعت یکبار لازم است، مناسب خواهد بود. دلمه بسته شده روی زخم دم به راحتی کنده می شود. اگر در فواصل زمانی کم احتیاج به خونگیری مجدد باشد می توان با برداشتن لخته تشکیل شده در دم، اقدام به خونگیری مجدد کرد. در این روش 0.2-0.5 میلی لیتر می توان بدست آورد. استفاده از تیغ برای بریدن نوک دم ممکن است باعث خونریزی طولانی شود و بافت اسکار ایجاد نماید. شایان ذکر است چیدن نوک دم میتواند منجر به وارد آمدن آسیب به غضروف و مهره های دمی شود.
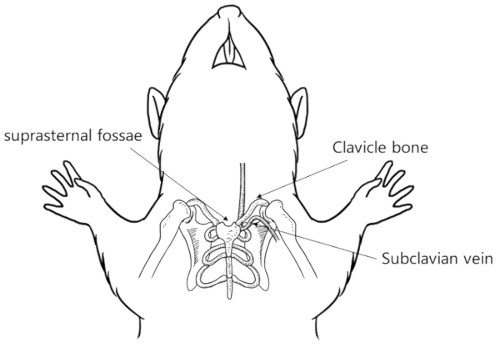
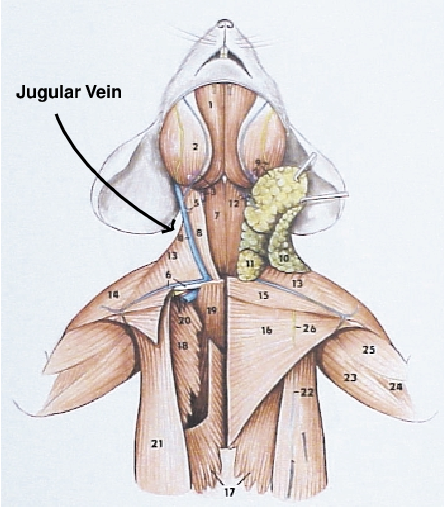
7- سیاهرگ وداج یا گردنی (ژوگولار): در این روش با عقب کشیدن سر حیوان، سیاهرگ وداج به طور واضح نمایان می شود. سیاهرگ وداج در 2 الی 4 میلیمتری محل اتصال جناغ با استخوان ترقوه قرار دارد. برای خونگیری از سرسوزن های شماره 25 استفاده می شود. مسیر ورود سرسوزن متمایل به دست حیوان بوده (با عمق 1 الی 3 میلیمتری و 2 الی 4 میلیمتر به سمت ناحیه جانبی محل اتصال جناغ با ترقوه) و از روی جناغ وارد سیاهرگ می شود. بیشترین آسیب ناشی از ورود سرسوزن، مربوط به ناحیه گردن می باشد که این امر به علت وجود رگ های خونی، نای، مری و غدد اصلی و اعصاب مهم در این ناحیه می باشد.
|
|
 |
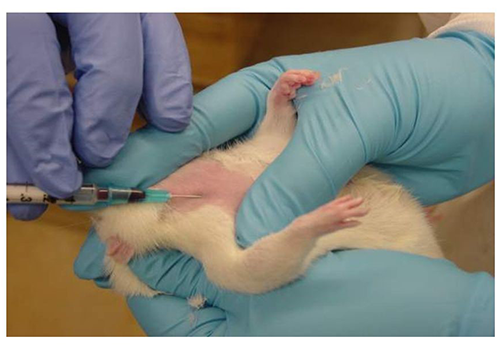 |
8- مستقیم از قلب (Cardiac Puncture): روشی انتهایی است و نیازمند بیهوشی عمیق میباشد. در این روش از خونگیری، حیوان را به پشت خوابانیده و میتوان از سرسوزن شماره 25 که از محل تلاقی جناغ با آخرین دنده و با حرکت به سمت چپ خط میانی بدن به ناحیه تشریحی قلب رسید. با رها کردن سرسوزن، ضربان قلب در سرسوزن مشاهده میشود که این یک علامت مهم از صحت مسیر ورودی سرسوزن میباشد. در ادامه و پس از اطمینان از رسیدن سرسوزن به قلب میتوان مقادیر مورد نیاز خون را جمعآوری نمود. برای خونگیری مستقیم از قلب از روش باز یا کالبدگشایی قفسه سینه نیز استفاده نمود که این روش برای افراد مبتدی به منظور حصول اطمینان بیشتر از صحت خونگیری توصیه میشود.
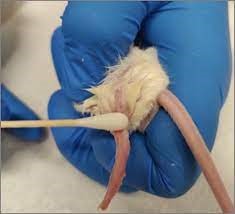
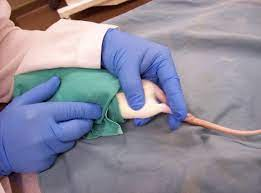
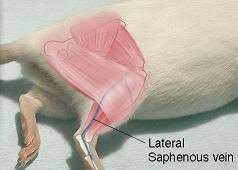
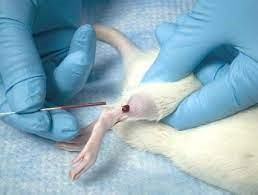
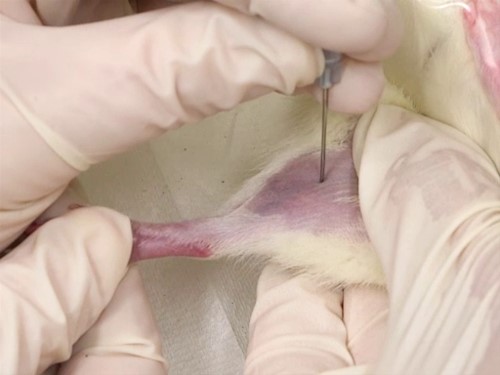
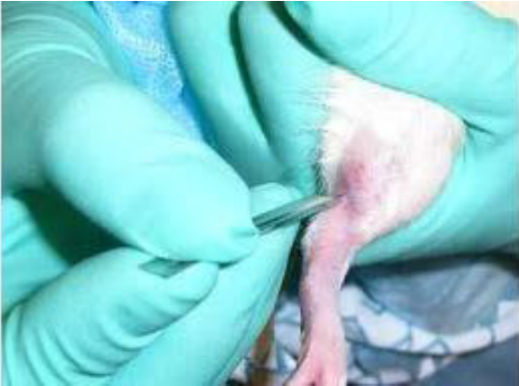
9- سیاهرگ سافنوس (Saphenous Vein): ابتدا حیوان را از قسمت سر وارد مقید کننده مکانیکی و یا کیسههای پلاستیکی کرده، پاهای خلفی را کشیده و با دو دست پوست بین دم و ران حیوان را نگه میداریم تا حیوان مهار شود. پای حیوان در این حالت ثابت و آماده خونگیری است. با یک تیغ جراحی (اسکالپل) کوچک موها را تراشیده و سیاهرگ سافنوس نمایان میشود. باید توجه داشت که با کشیدن پوست بین ناحیه خلفی ران و دم رگ ثابت میشود، سپس میتوان با لانست رگ را سوراخ نموده و با لوله موئینه اقدام به جمعآوری خون نمود. در مواردی که نیاز به خون بیشتری باشد، میتوان با سرسوزن شماره 23 یا 22 خونگیری نمود. پس از جمعآوری خون میتوان با استفاده از یک پنبه یا گاز استریل همراه با فشار عمل خونبندی را انجام داد.
 |
 |
 |
 |
 |
 |
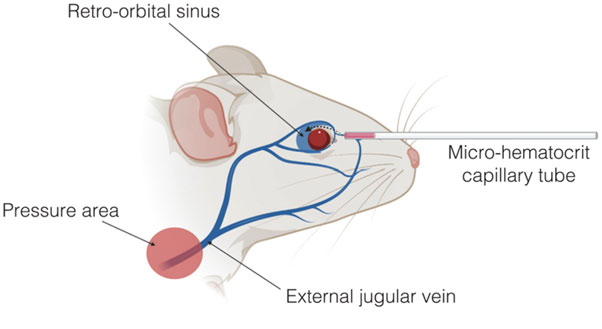
10- سینوس پشت چشمی (خلف حداقهای) (Retro Orbital Sinus): از این روش بیشتر در خونگیری با حجم کم استفاده می شود. این روش نیازمند مهارت و دقت بسیار بالایی است. یک مویرگ در میان سرخرگ های سینوسی حدقه چشم قرار دارد که منطقه مناسبی برای جمع آوری و مطالعه نمونه های خونی است. به منظور خونگیری، پوست ناحیه گردن حیوان باید طوری کشیده شود که چشمها کاملا بیرون زده و سپس از داروهای بی حسی موضعی مانند تتراکائین و پروپاراکائین به میزان یک قطره استفاده نمود (حتی میتوان از بیهوشی عمومی نیز بهره برد). توصیه می شود پس از 5-10 ثانیه مقادیر اضافی قطره را به کمک گاز استریل به آرامی از روی چشم پاک کرده و در حین پاک کردن چشم از وارد کردن آسیب احتمالی به قرنیه توسط گاز استریل پرهیز نمود. در ادامه از یک لوله موئینه که وارد گوشه چشم داخلی حیوان میشود می توان حجم خون مورد نیاز خود را جمعآوری کرد. لوله موئینه با زاویه 45 درجه به سمت قسمت میانی چشم وارد و در حین ورود حرکات ملایم چرخشی طوریکه لوله حول محور طولی خود بچرخد، بایستی انجام داد تا با پاره شدن سینوس چشمی خونگیری لازم را انجام داد. لازم به ذکر است عمق ورود نباید بیشتر از 3-4 میلیمتر باشد. در صورت عدم دقت کافی و وارد کردن نادرست لوله موئینه، به عصب بینایی و بافت های اطراف آسیب وارد شده و همچنین ممکن است کوری، عفونت، پارگی چشم، زخم (اولسر) و کراتیت مشاهده شود.
 |
 |
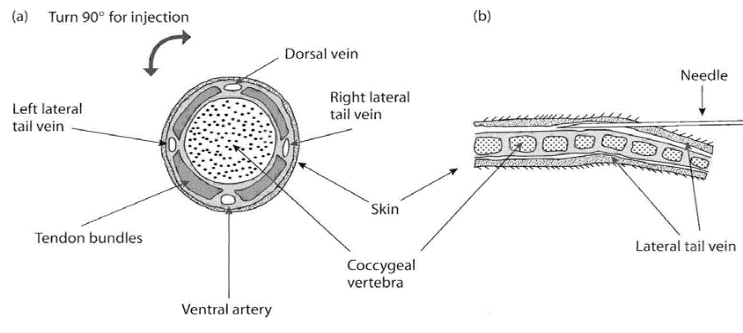
11- سیاهرگهای جانبی دم: برای خونگیری از رگهای دمی، میتوان از سیاهرگهای جانبی دم استفاده نمود. در ابتدای خونگیری بهتر است اقدام به گرم کردن محل خونگیری نمود تا جریان خون در ناحیه مذکور افزایش یابد. همچنین توصیه میشود از مالش زیاد دم خودداری شود؛ زیرا این عمل موجب افزایش تعداد گلبولهای سفید میشود. حیوان میتواند بیهوش شود یا اینکه در مقیدکننده مکانیکی قرار گیرد. در این حالت خون بدست آمده، خون وریدی خواهد بود.
 |
 |
مقالات بیشتر: